Categorie suggerite
- ...
PRODOTTI Vedi tutti
- ...
Vorrei parlare oggi di uno degli integratore che più mi ha colpito in questi anni per l’alta qualità e per le caratteristiche direi quasi uniche, questo integratore è la proteina idrolizzata Nutra Whey. Prima di entrare nelle specifiche vorrei fare una breve introduzione per sottolineare la differenza che si trova fra una proteina e l’altra. Le proteine sono formate da carbonio, idrogeno, ossigeno e azoto. La presenza dell'azoto differenzia le proteine dagli altri nutrienti, visto che a differenza delle piante l'uomo non può assorbire l'azoto dall'aria, le proteine costituiscono l'unica fonte di questo importante elemento. In breve il corpo utilizza la proteina per sintetizzare complesse strutture proteiche come i muscoli, la pelle o i capelli. Le proteine servono anche alla sintesi degli ormoni (GH), dell'insulina e del glucagone (sostanza antagonista dll'insulina secreta nel pancreas) e dell'albumina che è usata per il trasporto degli altri substrati attraverso il circolo ematico. Le proteine sono formate da aminoacidi (AAs) legati tra loro; esistono 20 AAs che si trovano nel cibo, sebbene la maggior parte sia già presente nel corpo. I singoli AAs sono detti peptidi, mentre quando due AAs vengono legati assieme formano un di-peptide, tre AAs formano un tri-peptide e quattro o più AAs formano un poli-peptide. L'α-elica e il β-foglietto sono le conformazioni più comuni riscontrabili nelle catene polipeptidiche di una proteina. Una singola proteina può prevedere sia α-eliche che β-foglietti in numero variabile. L'α-elica è la conformazione più comune riscontrabile nelle proteine, particolarmente presente nei recettori cellulari, dov'è immersa nella membrana plasmatica della cellula, spesso con più α-eliche per singola proteina (unite da catene polipeptidiche ad U). In questo caso i gruppi idrofobici sono a contatto con la membrana plasmatica e i gruppi idrofilici sono all'interno, oppure si affacciano al citoplasma e allo spazio extracellulare; l'elica è una delle conformazioni più favorevoli perché naturalmente riduce al minimo l'energia libera e può essere sinistrorsa o destrorsa. Fu scoperta per la prima volta nell'α-cheratina negli anni Sessanta. L'α-cheratina è un esempio di proteina che assume questa particolare conformazione, preferita dalle proteine con funzione strutturale. Il β-foglio pieghettato è la seconda conformazione più comune nelle proteine, molto presente in alcuni enzimi e nelle proteine coinvolte nella difesa immunitaria. Fu scoperto negli anni Sessanta studiando la fibroina che è la proteina principale costituente della seta. Il foglietto β pieghettato consiste in numerose catene polipeptidiche che si dispongono l'una adiacente all'altra, collegate in una struttura continua da brevi sequenze a U; queste catene possono puntare nella stessa direzione (catene parallele) o in direzioni alternate (catene antiparallele) le catene polipeptidiche adiacenti sono unite in una struttura rigida da legami idrogeno che connettono i legami peptidici di una catena con quella adiacente.
Le proteine hanno una struttura tridimensionale molto complessa a cui è associata sempre una funzione biologica. Da questa considerazione deriva uno dei dogmi fondamentali della biologia: "Struttura <--> Funzione", nel senso che ad ogni diversa organizzazione strutturale posseduta da una proteina (detta proteina nativa) è associata una specifica funzione biochimica. Da questo punto di vista le proteine possono essere classificate in due grandi famiglie: le proteine globulari e le proteine a struttura estesa o fibrosa. Queste due organizzazioni riflettono le due grosse separazioni funzionali che le contraddistinguono; le proteine estese o fibrose svolgono funzioni generalmente biomeccaniche, esse rientrano nella costituzione delle ossa, unghie, peli, dello strato corneo dell'epidermide, dei muscoli (actina e miosina), fornendo sostegno strutturale e opponendo una valida difesa contro il mondo esterno. Le proteine globulari sono coinvolte in specifiche e molteplici funzioni biologiche, spesso di fondamentale importanza per l'economia cellulare, sono proteine gli enzimi, i pigmenti respiratori, molti ormoni, le tossine, e gli anticorpi, responsabili della difesa immunitaria. La loro composizione in amminoacidi è variabile e sotto il controllo genetico per cui il loro peso molecolare può essere molto variabile e dipende dal numero e dal tipo di amminoacidi (monomeri) di cui è costituita la molecola. Se la molecola è costituita da poche unità di amminoacidi (in genere non più di 10) viene definita un "oligopeptide". Molecole con più di 10 unità sono dette "polipeptidi". Una proteina è formata da uno o più polipeptidi eventualmente accompagnati da uno o più gruppi prostetici ed il suo peso molecolare è generalmente non inferiore a 10.000.
Una proteina nella sua organizzazione nativa, e quindi funzionalmente attiva, può esistere solo in soluzioni saline diluite (molto simili, per composizione, a quelle esistenti nei sistemi acquosi cellulari). La sua struttura dipende esclusivamente dalle caratteristiche chimico-fisiche della soluzione acquosa in cui si trova (pH, presenza di ioni salini, temperatura, pressione, presenza di composti organici come urea, alcoli, ecc.). Il variare di questi parametri può determinare delle modifiche strutturali che possono alterare le proprietà funzionali, fino ad annullarle (proteina denaturata).
Che le proteine non siano tutte uguali ormai è chiaro a tutti, ci sono quelle più veloci da digerire e quelle più lente e fra i due estremi troviamo quelle a digestione media; il concetto di proteine veloci o lente è stato studiato eseguendo un test su soggetti in salute che avevano una normale assunzione proteica (il 16% del totale delle calorie). I soggetti vennero fatti digiunare per 10 ore e poi a un gruppo venivano somministrati 30 g di proteine del siero del latte e all'altro 30 g di caseina (proteina del latte). Il primo risultato fu che le proteine del siero del latte causarono un veloce aumento dei livelli di leucina nel sangue, con un picco dopo 1 ora dall'assunzione. I livelli di leucina calarono altrettanto velocemente, ritornando alla normalità dopo 4 ore. Diversamente la Caseina causò un innalzamento più lento dei livelli di leucina nel sangue. Anche se più bassi di quelli registrati per le proteine del siero del latte, i livelli di leucina causati dalla caseina rimasero costanti più a lungo, fino a 7 ore dall'assunzione.
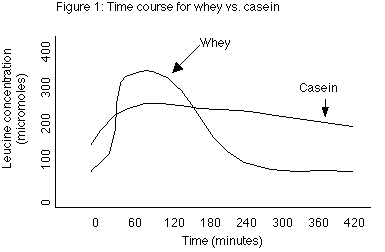
(fig.1) livelli temporali di leucina ottenuti con proteine del siero confrontate alla caseina
Inoltre i ricercatori trovarono che le proteine del siero del latte stimolavano la sintesi proteica e cioè la costruzione di catene di proteine a partire dagli aminoacidi liberi nel sangue, senza produrre effetti sulla scissione proteica, mentre le proteine della caseina inibivano la scissione proteica senza produrre effetti sulla sintesi proteica. Infine costatarono anche che il bilancio di leucina (totale ingerito contro totale immagazzinato) era più alto per la caseina che non per le proteine del siero del latte. Queste loro osservazioni si prestarono a varie interpretazioni. Da un lato gli effetti sulla sintesi proteica e sul risparmio proteico e cioè dell’inibizione della scissione proteica, indicano che le proteine del siero del latte sono "anaboliche", mentre quelle della caseina sono "anti-cataboliche". Qui possiamo capire quanto sia essenziale il timing d’assunzione rispetto agli obiettivi che vogliamo perseguire. Ma da cosa dipende la qualità di una proteina? La qualità di una proteine viene identificata dal suo valore biologico. Il valore biologico altro non è che un valore numerico, che si riferisce alla quantità, alla qualità ed al rapporto reciproco degli amminoacidi essenziali presenti nei peptidi alimentari. Le ricerche svolte dichiarano che le proteine a migliore valore biologico siano quelle contenute nelle uova (100), nel latte (91), nel manzo (80) e nel pesce (78); è importante sottolineare che ogni proteine, contenuta anche in cibi che presentano una minima parte proteica, ha un valore biologico; ad esempio le proteine contenute nel riso hanno valore biologico 59, quelle contenute nel grano lo hanno di 54 e le proteine contenute nei fagioli hanno un valore biologico pari a 34 (questo faccia riflettere su alcune dichiarazioni “vegane” tanto in voga di questi tempi). È importante tenere presente che la cottura dei cibi diminuisce il valore biologico della parte proteica. Un fattore importantissimo del metabolismo delle proteine riguarda l'assimilabilità delle proteine da parte del corpo umano, la loro digeribilità; a volte si sente sostenere l'idea che le polveri proteiche (come ad esempio le predigerite o idrolizzate) siano assimilate più efficacemente delle proteine intere derivanti dal cibo e occasionalmente si sente invece dire che le proteine dei vegetali siano più assimilabili di quelle animali. L'assimilabilità e quindi la digeribilità delle proteine non è nè un segreto nè una magia ma bensì un calcolo oggettivo, questa infatti viene misurata confrontando la quantità di azoto persa nelle feci (sottratta la quantità di azoto persa normalmente) con la quantità di azoto ingerita, pertanto, come sempre, informiamoci sempre bene basandoci su ciò che dice la scienza e tralasciamo completamente il sentito dire. Concludendo possiamo affermare che la ricerca sull'assimilabilità delle proteine verifica quanto azoto è perso in più del normale dopo che si è ingerito un determinato tipo di proteina.
Fonte: National Research Council. Recommended Dietary Allowances, 10th ed. National Academy Press, 1989.
Alla domanda inerente a quante proteine possono essere assimilate ad ogni singola assunzione non basterebbe un libro per fornire un’adeguata spiegazione pertanto mi limito a spiegarvi il ricambio proteico giornaliero. Ogni giorno il nostro corpo scinde e sintetizza proteine continuamente, pensate che un uomo medio può ricambiare circa 300 g di proteine nell'arco di 24 ore ma questo non significa che si debbano introdurre 300 g di proteine (molte delle proteine scisse vengono riutilizzate nel processi di sintesi proteica), dopo la scissione, alcuni AAs vengono ossidati e perdono l'azoto sotto forma di urea, creatinina e altri substrati; normalmente circa il 4% delle proteine "ricambiate" viene perso e l'azoto perso è eliminato principalmente attraverso le urine. Il bilancio azotato indica la differenza tra l'azoto introdotto con la dieta e l'azoto perso se un soggetto consuma più azoto di quello che perde il suo bilancio azotato sarà positivo. Un altro fattore che influenza pesantemente il bilancio azotato è l'apporto calorico della dieta, una dieta ipocalorica, ad esempio, fa perdere più azoto di una dieta ipercalorica con zero o poche proteine è inoltre importante sottolineare che le calorie dei grassi non migliorano il bilancio azotato cosi come quelle dei carboidrati e quindi per avere sempre il bilancio in positivo ci si debba alimentare almeno con delle buone quantità di carboidrati. È bene non dimenticare mai, quindi, che anche il tessuto a base proteica, come il tessuto adiposo, segue un turnover di ricambio, il ritmo con il quale il tessuto viene costruito e perso prende il nome di PTOR, da sottolineare che il muscolo viene costruito e distrutto in egual misura per garantire una situazione di omeostasi e che, a quanto pare dalle ultime ricerche, il nostro organismo sostituisca completamente il “vecchio” col “nuovo” ogni sei mesi. La proporzione tra questo continuo stato di catabolismo-anabolismo prende il nome di “Tasso di anabolismo-catabolismo”. La particolarità principale delle proteine idrolizzate Nutra Whey formulate da ProAction è di avere un’alta percentuale di leucina che arriva sulla materia prima quasi al 13% e sul prodotto finito quasi al 10%, questo ne fa una proteina particolarmente mirata al recupero post allenamento (e perché no, un buon integratore da consumare a colazione per tamponare rapidamente il digiuno notturno), fattore non da poco perché essendo la leucina inserita nell’insieme di tutti gli aminoacidi, la Nutra Whey risulta contenere una proporzione totale più alta della media di aminoacidi. Mi piace moltissimo il fatto che derivi direttamente da latte fresco e il non aver subito alcun trattamento termico la porta a risultare una proteina davvero naturale che aggiunto al forte impatto metabolico per gli aspetti appena accennati ne fa un’arma davvero importante per il raggiungimento dei nostri obiettivi.
Bibliografia
1. (EN) IUPAC Gold Book, "poltypeptides"
2. (EN) IUPAC Gold Book, "proteins"
3. Bean A. G 6. Neri M., Bargossi A., Paoli A. Alimentazione, fitness e salute. Italia, 2013, Edizioni Elika
4. Gaspari R., Vincere la Cellulite. Italia, 2020, LSWR Edizioni.
5. Murray et al., pp. 30–34.
6. Neri M., Bargossi A., Paoli A. Alimentazione, fitness e salute. Per il wellness, il dimagrimento, la prestazione, la massa muscolare. Italia, 2013, Edizioni Elika collana I grandi manuali dello sport
7. Neri M., Bertuccioli A. Manuale pratico di integrazione alimentare. Italia, 2015, Elika s.r.l. Editriceuida completa all'alimentazione sportiva. 2017, Elika s.r.l. Editrice
8. Pierantoni R., Cobellis G., Meccariello R. Fondamenti di biologia e genetica. Italia, 2018, Edises
9. Solomon E. P., Martin Diana W., Martin C.E. Biologia. 2017, Edises
10. Spattini M. Alimentazione e Integrazione per lo sport e la performance fisica. Italia, 2016, Edizioni LSWR (La Tribuna s.r.l.)
11. Spattini M. Antiaging e lo stile di vita integrato. Italia, 2013, Tecniche Nuove ED.
12. Spattini M. La DietaCOM e il dimagrimento localizzato. Italia, 2012, Tecniche Nuove ED.
13. Spattini M. La DietaCOM in pratica. Italia, 2014, Tecniche Nuove ED.
